Enigmatique "H2O" ...
... Ou comment prendre conscience des extraordinaires propriétés physiques et chimiques de l'eau !
__________________________________________________________________________________________

"Eau ... tu n'as ni goût , ni couleur , ni arôme ...
on ne peut te définir , on te goûte sans te connaître .
Tu n'es pas nécessaire à la vie ... Tu es la vie ! "
(Antoine de Saint-Exupéry / Terre des hommes)
_________________________________________________________________________________________
Quoi de plus "naturel" ...
... qu'une cascade jaillissant du haut d'une falaise ...

...Qu'un lac paisible reflétant l'azur ...

... Ou qu'une rivière serpentant entre des rives sauvages ...

Pourtant , du strict point de vue de la physique , rien n'est si évident ...
Car notre planète est la seule du système solaire et de l'univers "connu" à posséder de l'eau "liquide"
et notre pays , l'un des plus privilégiés du Globe en la matière !
Il n'existe aucun autre "liquide naturel" !
Tous ceux que nous consommons ou utilisons à diverses pratiques sont obligatoirement constitués
d'un mélange d'eau et d'autres composés !
Autrement dit , tout ce qui se présente sous forme "liquide" contient de l'eau !
Hé oui Amis Bourguignons !! ... même les bouteilles de vos plus prestigieux grands crus
contiennent un minimum de 87% d'eau !!
____________________________________________________________________________
Quoi de plus "facile" aujourd'hui pour nous que d'actionner un robinet ?

Et quoi de plus "normal" que de prélever quotidiennement sans compter à cette manne exceptionnelle !
Pourtant ... exploitée sans mesure ni prudence , l'eau est de plus en plus polluée
et sa potabilité est rendue de plus en plus complexe et coûteuse !

________________________________________________________________________
L'eau possède en effet des propriétés physiques originales et surtout "uniques" !
Elle est présente sur notre planète depuis sa formation et est en perpétuel mouvement entre ses différents réservoirs .
Autrefois indispensable à l'éclosion de la vie , elle l'est encore aujourd'hui à son maintien au sein
des écosystèmes présents sur tous les continents !
Nécessaire à nombre d’activités et de réalisations humaines, l’eau est une substance essentielle à la survie
et au développement de l’humanité.
Mais son exploitation intensive, la pollution croissante des réserves, les besoins grandissants d’une population mondiale en plein essor, le manque chronique enduré par certains pays, et la gestion irréfléchie de certains états, soulèvent nombre d’interrogations : Que va devenir cette fragile ressource ? Quelles sont les modalités de sa préservation ? Quels sont les risques de pénurie encourus par notre planète ? Le manque d’eau est-il susceptible de générer de nouveaux conflits entre états ?
Vous pouvez donc voir que les nombreuses problématiques de l'eau sont aussi diverses que complexes !
| Dans ce billet , je n'aborderai que son aspect "physico-chimique" afin de vous expliquer le plus "limpidement" possible pourquoi ses propriétés encore en partie "inexpliquées" en font un "matériau" unique dans l'Univers ! |
_________________________________________________________________
Préambule ...
Petite introduction aux "Atomes et Molécules" :
Qu’elle soit inerte ou vivante, d’origine naturelle ou artificielle, la matière est faite de l’assemblage plus ou moins régulier et plus ou moins dense de toutes petites particules que l’on appelle des atomes .
Telles les briques d’un mur d’habitation, ces atomes sont en quelque sorte les éléments qui fondent toute la matière de notre Terre et d'une bonne partie de l’Univers !
Mais ces briques sont si petites qu’elles demeurent irrémédiablement invisibles à notre œil : il faudrait en effet empiler environ un million d’atomes pour obtenir l’épaisseur d’un cheveu !
Ces atomes restent rarement seuls, ils s’associent spontanément les uns aux autres.
Et bien que leur nombre soit limité, la diversité des assemblages auxquels ils conduisent a permis d’engendrer la très grande variété du monde qui nous entoure.
Dans la nature, on peut trouver ces atomes réunis en très grand nombre, comme dans les métaux par exemple : c’est ainsi que le cuivre est un assemblage très ordonné d’atomes , idem pour le zinc, l’aluminium, le plomb…
 Assemblage d'atomes de Cuivre (Cu)
Assemblage d'atomes de Cuivre (Cu)
Ces atomes peuvent aussi s’associer en nombre limité !
Ils forment alors une entité que l’on appelle une molécule !
Une molécule étant un ensemble fini et stable d’atomes arrangés selon une géométrie particulière .
Il en existe de toutes les tailles !
Les plus petites sont constituées de deux atomes, telles les molécules d'hydrogène notées H2 et les molécules d'oxygène notées O2 .
Mais il en existe aussi de très grosses, formées d’un très grand nombre d’atomes : c’est le cas des molécules dont sont constitués les polymères (les plastiques, les colles…); celles-ci sont en effet formées de l’enchaînement d’un même motif moléculaire répété plusieurs centaines ou milliers de fois.
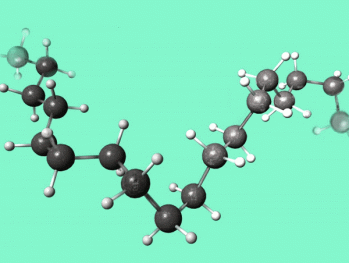
Molécule de Polyéthylène ( CH3 - (CH2)n - CH3)
Ces molécules peuvent elles-mêmes se rassembler entre elles de manière très variée.
Groupées en très grand nombre, elles donnent alors naissance à d’autres corps .
_________________________________________________________________________
Qu’en est-il de l’eau ?

L'eau , une molécule "polaire" ...
L’eau est un corps dont l’unité de base est une molécule : la "molécule d’eau".
Elle est formée d’un atome d’oxygène (en rouge) relié à deux atomes d’hydrogène (en gris ).
On la note H2O (H pour hydrogène et O pour oxygène).
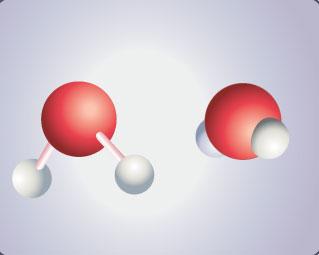
Deux représentations de la molécule d'eau (avec et sans "bâtons")
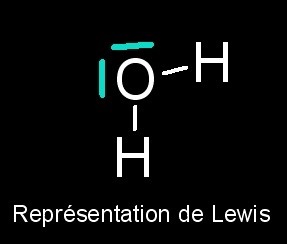
Du fait de la présence de deux doublets non liants sur l'atome d'oxygène, l'eau a une structure tétraédrique (type AX2E2 en méthode VSEPR). La géométrie de la molécule d'eau est donc coudée. Les études spectroscopiques montrent que l'angle H-Ô-H est de 104,5° et que la distance interatomique dO-H = 95,7 pm (picomètre) soit 9,57.10-11 m.
En première analyse, tous les atomes sont formés d’un noyau dense, porteur d’une charge électrique positive, autour duquel gravitent des électrons , particules élémentaires , porteurs d’une charge électrique négative.
Mais du point de vue de la charge électrique, un atome est toujours globalement neutre, sans charge !
Le plus petit de tous les atomes est l'atome d'hydrogène qui ne possède qu'un seul électron !
Ci-dessous , une animation représentant de manière "conventionnelle" la course de l'électron d'un atome d'Hydrogène

|
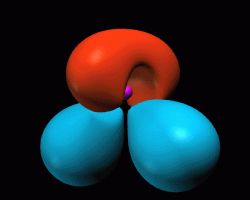
Il est courant de représenter un atome en faisant tourner ses électrons ("son" électron dans le cas de l'atome d'hydrogène) autour de son noyau car un tel modèle est facilement compréhensible ! En réalité , nous ne connaissons pas le mouvement des électrons, mais nous pouvons en revanche calculer la probabilité de trouver un électron en un lieu donné autour du noyau et représenter alors l’atome comme ci-dessous. |
La présence de ces électrons est très importante car ce sont eux qui permettent aux atomes de se lier les uns aux autres.
En effet, dans une molécule, l’union entre deux atomes , la liaison chimique , est assurée grâce à la mise en commun par chacun d’eux, d’un (voire de deux ou trois) électrons.
Les électrons ainsi "partagés" n’appartiennent plus ni à l’un, ni à l’autre des atomes mais aux deux !
Un tel "partage" n’est pas toujours équitable, car certains atomes peuvent être plus avides d’électrons que d’autres.
C’est ce qu’il se passe dans la molécule d’eau, où l’oxygène a tendance à capter plus fortement les électrons que l’hydrogène.
Dans cette molécule, la charge négative des électrons engagés dans les liaisons n’est donc pas répartie de manière homogène entre les atomes d’hydrogène et d’oxygène : l’atome d’oxygène est chargé négativement et l’atome d’hydrogène positivement.
On dit d’une telle molécule que c’est une "molécule polaire" !
Cette polarité est une propriété extrêmement importante de la molécule d’eau !
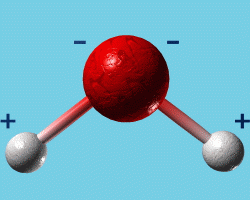
Représentation schématique de la molécule d'eau La représentation très schématique de la molécule d’eau proposée ci-dessus ne permet pas de voir de quelle manière les électrons de chacun des atomes sont répartis au sein de la molécule.
La molécule d’eau possède en effet au total dix électrons dont huit proviennent de l’atome d’oxygène, les deux autres provenant des deux atomes d’hydrogène ! |
Au sein de toute matière, quel que soit son état, les briques de base qui la fondent, atomes ou molécules , ne sont jamais immobiles mais en perpétuelle agitation. Et ce mouvement continuel est directement corrélé à la température : il est de moins en moins important lorsque la température diminue et inversement. Car en fait la température est une mesure de ce qui se passe au niveau microscopique, c’est-à-dire au niveau des atomes et des molécules. On appelle ce phénomène l'agitation thermique !
Pour l’eau, bien sûr, il en est de même : ses molécules sont plus ou moins agitées en fonction de sa température !
Mais que se passe-t-il exactement dans chacun de ses états gazeux, liquide, ou solide ?
_______________________________________________________________
Les trois états de l'eau ...
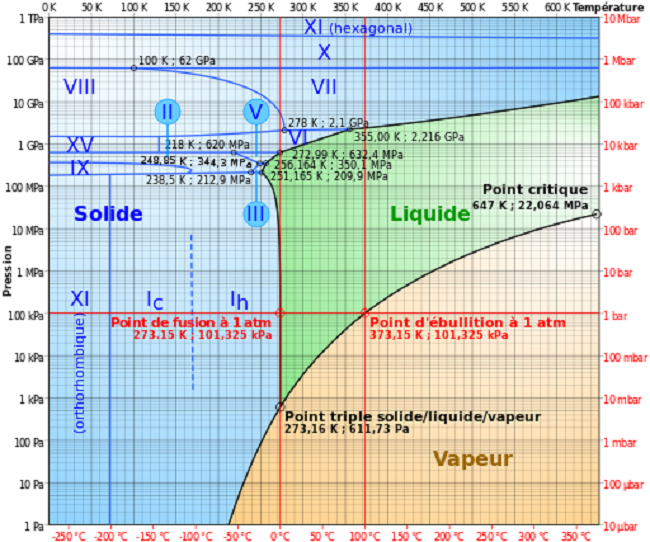 Diagramme de phase de l'eau
Diagramme de phase de l'eau
1) Gazeux (vapeur d'eau) :
Contrairement à l'idée reçue largement répandue , le terme "vapeur d'eau" ne s'applique pas au "brouillard" que vous voyez se répandre dans votre cuisine pendant la cuisson de vos légumes dans la "cocotte minute" ! Vous assistez là à un simple phénomène de "condensation " !
La vapeur d'eau est en réalité un "gaz" incolore , inodore et parfaitement indétectable à l'œil nu !
En effet , à pression atmosphérique et température stables et "normales" , l'air que nous respirons est en permanence et à divers degrés de saturation , "chargé" en humidité !
Pourtant , il reste transparent ! Ce n'est que quand ce "gaz" est soumis à de soudains écarts de température ou de pression qu'il entame son processus de condensation et qu'il se matérialise sous forme de "brouillard" avant sa transformation en eau "liquide" !
La vapeur d’eau est générée naturellement par l’évaporation des océans et des eaux de surface, ainsi qu’au cours du phénomène d’"évapotranspiration".
Au cours de ce processus, la vapeur d’eau est libérée via les feuilles des plantes, la respiration des animaux et des hommes ainsi que l’évaporation des eaux souterraines.
Une partie très infime de la vapeur d’eau atmosphérique est liée aux activités humaines, notamment industrielles, où elle est utilisée principalement comme fluide caloporteur (réacteurs nucléaires, chauffage urbain, géothermie...)
Au sein de la vapeur d’eau l'agitation thermique des molécules d’eau est grande : elles se déplacent en tous sens, séparément les unes des autres et de façon apparemment désordonnée, défiant les lois de la pesanteur car l’énergie thermique qui les habite est suffisamment importante pour les empêcher de s’associer et de tomber sous l’action de leur poids.
Un tel comportement est typique de tous les gaz !
La vapeur d’eau est donc un gaz "normal" !
Comme pour tous les gaz, il est possible de comprimer la vapeur d’eau car l’espace entre les molécules est suffisamment grand pour leur permettre de se rapprocher les unes des autres : on dit qu’elle est compressible.
Inversement, donnez lui plus d’espace, elle occupera tout le volume disponible grâce à l’agitation des molécules qui se déplacent partout où c’est possible : comme tous les gaz, la vapeur d’eau est expansible.
2) l'eau liquide et la "liaison hydrogène" :
Lorsque l’on refroidit la vapeur d'eau , l'agitation thermique des molécules d’eau diminue.
Lorsque leur énergie d’agitation n’est plus suffisante pour les en empêcher, les molécules commencent à se lier les unes aux autres.
Elles se rassemblent en paquets pour finalement former, au sein de la vapeur d’eau, des gouttes d’eau liquide qui tombent sous l'action de leur poids !
La vapeur se transforme ainsi progressivement en eau liquide !
Des liaisons peuvent en effet se former entre les molécules d’eau car ce sont des molécules polaires et les charges de signes contraires s’attirent.
Ces liaisons, dues à la polarité, s’établissent entre les atomes d’hydrogène de certaines molécules d’eau et les atomes d’oxygène de molécules d’eau voisines.
On les appelle "liaisons hydrogène" !
De telles liaisons peuvent exister dans la vapeur d’eau, mais l’énergie d’agitation des molécules y étant supérieure à l'énergie de ces liaisons, les molécules ne peuvent s’associer en grand nombre.
Elles peuvent tout au plus s’associer par deux ou par trois pour former ce que l’on appelle des dimères ou des trimères.
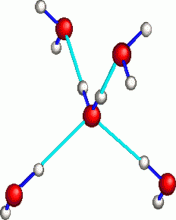
Dans l’eau liquide en revanche, les molécules d’eau s’associent les unes aux autres sous la forme de paquets de grande taille qui se font et se défont en permanence.
L’eau est le seul liquide à développer un aussi grand nombre de ces liaisons hydrogène qui jouent un rôle extrêmement important en lui conférant des propriétés très particulières !
Malgré la présence de ces liaisons, dans l’eau liquide les molécules d’eau ont encore la possibilité de changer de positions, car l'agitation thermique est encore importante et a pour effet principal de permettre à ces liaisons de se tordre.
|
La "Liaison Hydrogène" 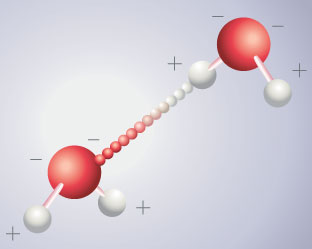
Liaison hydrogène entre deux molécules polaires d'eau La liaison hydrogène , est une liaison dont peu de monde soupçonnait l'importance, il y a quelques années encore ! C'est peut-être là leur rôle fondamental, et ce serait grâce à cela que la vie est née dans l'eau et s'y poursuit ! |
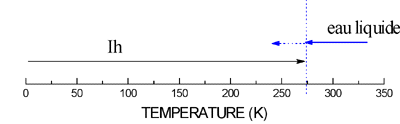
3) La Glace :
Lorsque l’on refroidit l’eau liquide, l'agitation thermique des molécules d’eau diminue progressivement et les liaisons hydrogène , qui pouvaient aisément se tordre dans le liquide, se raidissent progressivement pour devenir pratiquement rectilignes .
Les molécules d’eau forment alors une structure rigide très organisée : l’eau s’est transformée en glace !
Dans la glace, aussi bien que dans l'eau liquide, toutes les molécules d'eau sont reliées entre elles par des liaisons hydrogène et sont en relation avec quatre molécules voisines.
Mais, alors que dans l'eau liquide l'agitation thermique résiduelle permet aux liaisons hydrogène de se tordre, donnant aux molécules d’eau une certaine liberté de mouvement, au sein de la glace, l’agitation thermique des molécules d’eau est réduite au minimum : les molécules ne peuvent plus changer de position, elles ne peuvent que vibrer autour de cette position.
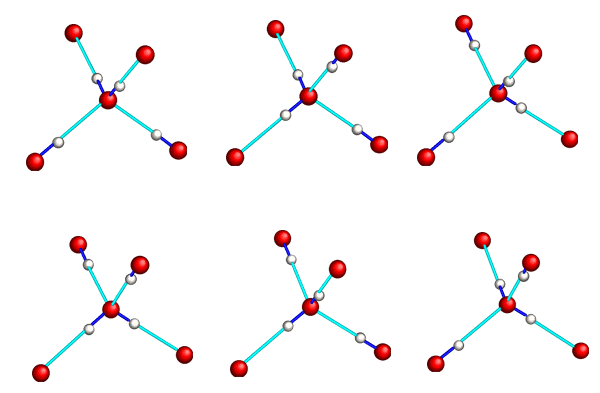
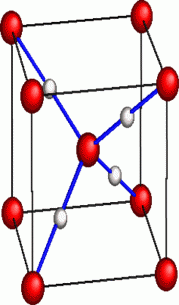
Elles forment un ensemble structuré où chaque atome d’oxygène est au centre d’un tétraèdre dont les sommets sont occupés par les atomes d’oxygène des 4 molécules d’eau voisines.
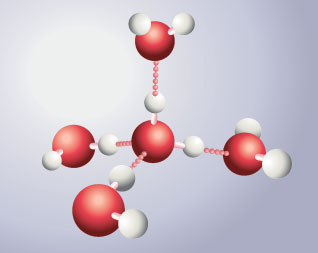 assemblage de molécules d'eau dans la glace
assemblage de molécules d'eau dans la glace
__________________________________________________
De très étranges propriétés ...
Sur Terre dans ses trois états :
Quotidiennement , sans vraiment nous en préoccuper , nous côtoyons chacun des trois états de l’eau et opérons même souvent des changements d’état en fabriquant des glaçons, en la faisant bouillir , ou encore en faisant se condenser son gaz sur un couvercle au-dessus d’une casserole d’eau bouillante.
Pourtant, si l’eau se comportait "normalement " dans les conditions de pression atmosphérique "normale" , elle devrait bouillir à moins 80°C et se solidifier à moins 110°C !
Il ne devrait y avoir non plus ni eau liquide, ni glace sur Terre !
Comme pour tous les composés de structure semblable, toute l’eau de notre planète devrait être sous forme gazeuse !
Mais si tel avait été le cas, il n’aurait pu y avoir de vie sur Terre… du moins telle que nous la connaissons !
Comment expliquer cette "anomalie" ?
Cela est tout simplement dû à la présence des "fameuses" Liaisons Hydrogène !
En effet, en règle générale, la surface d’un liquide n’est guère "tranquille" : elle est le siège d’un échange réduit mais constant de molécules qui quittent le liquide pour passer dans l’atmosphère gazeuse environnante pendant que d’autres y reviennent.
Mais que l’on chauffe ce liquide et l’agitation thermique des molécules augmentera, favorisant ainsi leur expulsion du liquide.
À une certaine température, dite température d'ébullition , le liquide se mettra à bouillir, laissant s’échapper quantité de molécules dans l’atmosphère !
Mais dans l’eau, ne l’oublions pas, les molécules sont liées les unes aux autres par des liaisons hydrogène.
Elles ont donc plus de difficulté à passer dans la phase gazeuse car il faut auparavant qu’elles aient acquis suffisamment d’énergie pour rompre ces liaisons. Pour fondre la glace, il en est de même : il faut d’abord que l’énergie d’agitation des molécules soit suffisante pour qu’un grand nombre de liaisons hydrogène puissent être tordues !
Aussi sur Terre, à la pression atmosphérique normale, la glace fond à 0°Celsius et l’eau liquide bout à 100°Celsius pour le plus grand bonheur de l’humanité !
Si les liaisons hydrogène peuvent être tordues et même brisées, c’est qu’elles sont dix fois plus faibles qu’une liaison chimique ordinaire !
Mais il aurait suffi qu’elles soient légèrement plus fortes et ne puissent donc se tordre aussi aisément, pour que l’eau soit encore solide à 100°C !
Comme pour tous les autres corps, les températures de changement d’état de l’eau changent avec la pression.
La température d’ébullition de l’eau par exemple diminue quand la pression diminue : en montagne, où la pression atmosphérique est plus faible qu’en bord de mer, l’eau bout donc à une température plus basse et c’est la raison pour laquelle les aliments y sont plus longs à cuire.
Essayez de cuire un œuf dur dans un refuge de haute montagne ... vous n’y arriverez pas !
En revanche, contrairement à tous les autres corps, la température de fusion de la glace diminue quand la pression augmente : c'est un autre comportement tout à fait étonnant !
Autrement dit, essayez de la comprimer : elle fond ! pour la plus grande joie des patineurs, d’ailleurs !
Grâce au film de molécules d’eau organisées presque comme dans l’eau liquide qui se forme instantanément sous leurs patins à la surface de la glace, ceux-ci peuvent en effet glisser librement sur cette surface. Ce sont encore les liaisons hydrogène qui sont à l’origine de ce phénomène : sous l’effet d’une compression, celles-ci, en effet, s'affaiblissent et se tordent…
Une étonnante inertie thermique :
Si les changements d’état de l’eau se produisent à des températures beaucoup plus élevées que la "normale", les quantités d’énergie nécessaires pour faire fondre la glace, vaporiser l’eau liquide ou tout simplement élever sa température sont elles aussi très élevées.
En effet, pour élever de 1°C la température "d’une masse donnée d’eau", il faut dépenser 4 fois plus d’énergie que pour élever de 1°C la température de la "même masse d’air" et 10 fois plus que pour élever de 1°C la température de la "même masse de fer" !
Les responsables de cet état de fait : une fois encore les "liaisons hydrogène" !
Pour élever la température de l’eau, il faut en effet augmenter l’agitation des molécules qui la composent.
Or les liaisons hydrogène qui lient ces molécules entre elles réduisent leur capacité d’agitation.
Pour combattre cet effet, il faut donc dépenser plus d’énergie que si ces liaisons n’existaient pas !
Les conséquences sur le climat d’un tel comportement sont très importantes car les grandes masses d’eau océaniques peuvent emmagasiner le jour puis restituer la nuit de grandes quantités d’énergie solaire sans pour autant que leur température varie beaucoup. Les océans sont ainsi d’excellents régulateurs de la température du globe terrestre.
Cette propriété est également très prisée par l’industrie qui utilise l’eau comme liquide de refroidissement ou pour emmagasiner et transporter l’énergie !
Un liquide très fluide :

Impossible de la garder longtemps au creux d’une main bien serrée car l’eau liquide est très fluide. De toute évidence, les molécules d’eau peuvent donc facilement glisser les unes sur les autres !
Et pourtant , du fait de leur "rigidité" , les "liaisons hydrogène" devraient produire l'inverse !
Cette question ne fait pas encore l’unanimité dans la communauté scientifique !
Pour certains , c’est la rupture puis la recombinaison des liaisons hydrogène, pour d’autres c’est leur souplesse, leur capacité à se tordre, qui permettrait aux molécules d’eau de circuler aussi librement les unes par rapport aux autres.
Si vous la "comprimez" , elle devient encore plus fluide , contrairement à ce qu’il se passe pour tous les autres corps !
Pourquoi ? Sous l’effet de la compression, pour des pressions pas trop élevées et des températures voisines de 0°C, les liaisons hydrogène s'affaiblissent de plus en plus en se tordant … à tel point qu’il est impossible de transformer l’eau liquide en glace par simple compression, un comportement hautement "ésotérique" !
Comme vous pouvez le constater , comprendre la molécule d'eau est un véritable "casse-tête" !
En effet , si l'eau est une substance très familière, et certainement l'une des plus étudiées et des mieux comprises à notre échelle, c'est certainement l'un des liquides que l'on sait le moins bien décrire à l'échelle moléculaire !
Pourtant dans beaucoup de pays, de nombreuses équipes travaillent d'arrache-pied à essayer de le comprendre en s’appuyant sur de nombreuses techniques expérimentales modernes, essentiellement la spectroscopie optique, infrarouge ou Raman , la fluorescence résolue dans le temps , la Résonance Magnétique Nucléaire (RMN), et la diffusion de rayons X ou de neutrons, ou encore en mettant en œuvre des approches théoriques très sophistiquées.
La molécule de base de ce liquide est bien sûr la molécule H2O qui n'est entourée que de molécules semblables. Et c'est là que commencent les problèmes, car ces petites molécules établissent un très grand nombre de liaisons hydrogène entre elles, autant que de liaisons de valence.
Comment se peut-il alors que l'eau soit un liquide très fluide ?
On sait bien décrire un liquide ordinaire : c'est un corps constitué de molécules assez grosses, qui n'interagissent que par des liaisons peu directionnelles et de faible énergie.
A température suffisamment basse, cette interaction fige les molécules les unes par rapport aux autres, et on a un solide.
Si l'on élève la température, ces molécules vont devenir de plus en plus mobiles les unes par rapport aux autres et vont pouvoir en particulier tourner l'une par rapport à l'autre ce qui affaiblira fortement leur interaction et leur permettra de glisser les unes sur les autres.
Mais rien de tel dans l'eau du fait de la présence des nombreuses liaisons hydrogène !
On pourrait penser que certaines de ces liaisons se rompent, donnant ainsi de la mobilité aux molécules.
Mais le nombre de liaisons à rompre pour arriver à un tel résultat s'avère beaucoup trop élevé : en effet, du fait de la grande énergie relative des liaisons hydrogène, cela nécessiterait une dépense énergétique bien supérieure à la chaleur qu'il faut effectivement fournir à la glace pour la transformer en eau liquide.
La spectroscopie infrarouge montre par ailleurs que le nombre de liaisons hydrogène rompues dans l'eau est très faible, bien insuffisant pour valider un tel mécanisme !
L'image la plus plausible actuellement est que les liaisons hydrogène sont tordues !
Elle permet d'expliquer d'une manière qualitative les principales propriétés physiques exceptionnelles de l'eau, comment elle se contracte quand on la chauffe ou devient plus fluide quand on la comprime, le tout au voisinage de 0°C.
Pour aller plus loin et avoir une théorie suffisamment précise pour reproduire quantitativement les résultats expérimentaux, il faudrait connaître le mécanisme à la base de cette torsion, ce qui n'est pas encore le cas.
On ne dispose donc aujourd’hui d'aucune description quantitative de "la dynamique des molécules H2O", et on ne peut dire comment ces molécules se positionnent entre elles ni comment ces positions relatives évoluent avec le temps.
On est incapable d’estimer de combien l'eau se contractera avec la température ou se fluidifiera avec la pression.
On ignore par quel mécanisme les molécules peuvent tourner ou se translater les unes par rapport aux autres. On ne sait donc pas ce qui fait de l’eau, à notre échelle, un liquide ordinaire.
Le résultat de tout cela est une prolifération dans la littérature scientifique d'innombrables articles, importants mais souvent incompatibles entre eux, qui ont néanmoins le mérite d'initier ceux qui ne le sont pas à la notion de chaos....
Un Solvant "quasi" Universel :
Ajoutez du sel à de l’eau et agitez !
Très rapidement, l’eau redevient claire et le sel n’est plus visible : on dit que le sel s’est dissous dans l’eau.
De même, le sucre se dissout très bien dans l’eau.
L’eau est en effet un très bon solvant !
Elle dissout un grand nombre de corps "ioniques", comme les sels par exemple dont les briques de base sont des ions , ainsi que certaines substances formées de molécules polaires !
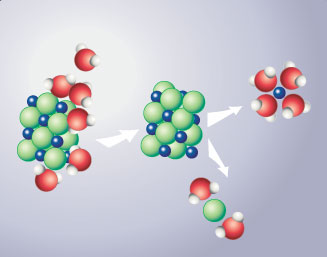 Représentation du processus de dissolution du sel de cuisine (chlorure de sodium) dans de l'eau .
Représentation du processus de dissolution du sel de cuisine (chlorure de sodium) dans de l'eau .
(le chlorure de sodium est formé de l'assemblage régulier d'ions "chlorure" chargés négativement et d'ions "sodium" chargés positivement )
Ce phénomène de dissolution résulte du caractère également polaire des molécules d’eau qui, du fait des charges positives et négatives dont elles sont porteuses, sont attirées par les charges de signes contraires des ions ou des molécules polaires qui leur sont proches.
Elles forment alors un écran autour de ces ions ou de ces molécules polaires, les séparant de leurs congénères et favorisant ainsi leur dispersion au sein du liquide.
Aux molécules polaires, elles se lient même par liaisons hydrogène .
Outre de nous permettre de saler ou de sucrer avec délice nos aliments, cette propriété fait de l’eau, pour le meilleur et pour le pire, le véhicule privilégié de substances variées !
Ainsi , nombre de substances vitales sont acheminées par l’eau à travers le corps humain ou les plantes.
Dans la nature, lorsqu’elle dévale les pentes, l’eau dégrade les roches et se charge en sels minéraux solubles.
Enfin, au gré de son périple, elle lessive les sols, drainant toutes les substances toxiques solubles qu’elle rencontre, comme les nitrates issus des engrais, devenant ainsi un véritable vecteur de pollution !!
Surprenante "légèreté" de la Glace :

Comment ces monstrueux morceaux de glace détachés de la banquise que sont les icebergs peuvent-ils dériver à la surface des océans ?
Pourquoi les glaçons flottent-ils en tintant dans nos verres ?
Pourquoi lacs et rivières gèlent-ils en surface en hiver ?
Voilà encore des phénomènes bien étranges car, en règle générale, les corps sont tous plus denses à l’état solide qu’à l’état liquide !
Mais il y a une exception, et pratiquement une seule, à cette règle : l’eau !
La glace est en effet moins dense, et donc plus "légère" que l’eau liquide !
Et tout cela , grâce à (ou à cause de) ces très fameuses "liaisons hydrogène" !
Bien qu’il y ait autant de liaisons hydrogène dans la glace que dans l’eau liquide, dans la glace elles sont rectilignes alors que dans l’eau liquide elles sont tordues .
Les distances entre molécules d'eau sont donc légèrement supérieures dans la glace à ce qu’elles sont dans l'eau liquide.
Il y a donc beaucoup plus de "vide" dans la glace que dans l’eau liquide et c’est tout simplement pour cela que la glace est moins dense !
Cela explique aussi que lorsqu’une bouteille ou une canalisation pleine d’eau gèle, elle se brise : la glace étant moins dense que l’eau liquide, une même quantité d’eau occupe un volume plus grand sous forme de glace qu’à l’état liquide; cela signifie qu’en gelant l’eau se dilate, faisant éclater ses contenants.
|
Quelques Généralités sur la Physique de la Glace L’eau, de formule chimique H2O, sous forme vapeur, liquide ou solide, joue un rôle essentiel dans l’équilibre de notre planète.
Ainsi, malgré l’aspect dynamique du système dû à la mobilité des molécules,
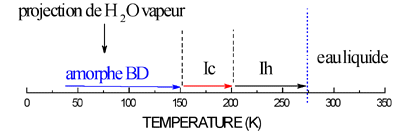
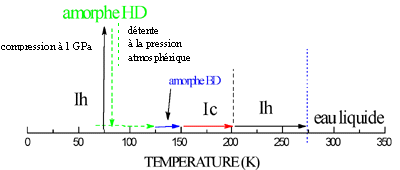
D’autres formes de glace à pression atmosphérique D’autres formes de glace peuvent être obtenues à pression atmosphérique.
2- ) D’autres glaces formées sous haute pression peuvent aussi être détendues à pression atmosphérique, mais ceci doit toujours être fait à basse température.
Ces études sous haute pression ont un grand intérêt dans les sciences fondamentales que sont la Physique du Solide et les Sciences des Matériaux : en physico-chimie, l’évolution de la liaison hydrogène avec la distance "oxygène-oxygène" est un point crucial ; un autre sujet est l’étude du changement des potentiels "interatomiques" et "intermoléculaires" avec la densité et la modification de la nature des matériaux sous pression. |
Bien ... chers amis ... je pourrais continuer ainsi pendant des heures , et vous parler par exemple de la vapeur d'eau et de la glace présentes également aux "quatre coins" de l'univers "connu" , ou des 36 formes différentes de flocons de neige , ou bien encore de la "suprême" importance de la liaison hydrogène dans "l'étonnant breuvage" qu'est le "Pastis" ... mais ... ce serait abuser de votre temps et de votre patience !!
Inutile donc pour vous de prendre une seconde "aspirine" ...
Pour vous remercier d'avoir lu ce billet , je termine par un petit bonus "ludique" !
Bien ... nous savons tous que l'eau arrive à la surface du globe par l'intermédiaire des nuages qui sont eux-mêmes créés et constitués par accumulation et condensation de vapeur d'eau (gaz) provenant de l'évaporation de l'eau de surface !
L'eau obéit donc à un cycle que nous pouvons aisément comparer à un "circuit fermé" !
Puisque l'eau est présente sur terre dans les mêmes quantités depuis des millénaires et qu'elle se "recycle" en permanence , il n'est donc pas faux de dire que les "mêmes molécules" sont en "circulation" depuis le début ! (le volume d'eau sur Terre est constant depuis plus de trois milliards d'années)
Partant de ce constat , il n'est donc pas idiot non plus de penser que lorsque vous tirez un verre d'eau à votre robinet , il soit fort probable que vous partagiez quelques molécules ayant servi à désaltérer un homme de "Cro-Magnon" s'abreuvant à l'onde pure d'un ruisseau du tout début de l'ère quaternaire !!
Vous êtes septiques ?
Bien ... formalisons le problème pour comprendre !
Comme on l’apprend en chimie, le nombre d’"Avogadro" vaut environ 6.1023
Pour ceux qui l’auraient oublié, ce nombre quantifie les molécules contenues dans ce qu’on appelle une mole, comme par exemple le nombre de molécules contenues dans 18 g d’eau !
Maintenant ... actionnez votre robinet et remplissez un verre d'eau ...
Parfait ! A présent , observez en attentivement le contenu et dites-vous qu'il contient 10 millions de milliards de milliards de molécules H2O (1025) !
Oui ... c'est astronomique et difficilement visualisable !
A titre comparatif : En ajoutant le volume des océans et des eaux continentales (fleuves , lacs , glaciers , nappes souterraines ... etc ) à celui de la vapeur d'eau contenue dans l'atmosphère ainsi qu'à celui présent dans la biosphère (cellules vivantes) , on atteint la somme de 1,4 milliard de kilomètres-cubes d'eau présente sur Terre ! ("l'eau douce" ne représente que "3%" du volume global)
1,4 milliard de km3 (1 400 000 000 km3) d'eau est équivalent à 5.1046 molécules ou 5.1021 verres .
Puisque le "brassage" planétaire de l'eau est constant mais tout à fait aléatoire , considérons maintenant la probabilité que vous puissiez goûter aujourd'hui à quelques molécules ayant désaltéré notre lointain cousin il y a 35 000 ans !
En divisant le nombre de molécules contenues dans votre verre par celui du volume total de l'hydrosphère ...
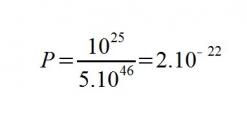
... nous obtenons effectivement une très faible probabilité !
MAIS ... en multipliant cette probabilité par le nombre de molécules qu’un verre d’eau contient, on arrive au résultat étonnant que dans le verre d’eau que vous êtes en train de boire, il y a en moyenne 2 000 molécules d’eau qui ont également ravi les papilles de "Cro-Magnon" !!
C'est purement mathématique , et cela tient essentiellement au fait qu'il y a plus de molécules dans votre verre d'eau que de verres d'eau sur Terre !
"Avogadro" est Grand ... très Grand !
Ce qui nous conduit à admettre que dans chacun des verres d'eau que nous buvons , il y a un peu de celle bue par d'autres depuis le début de l'histoire de l'humanité !
Fascinant ... ou "Dégoutant" !! ... selon , bien sûr , votre propre idée du "partage" !!
____________________________________________________
Pour aller un peu plus loin ...
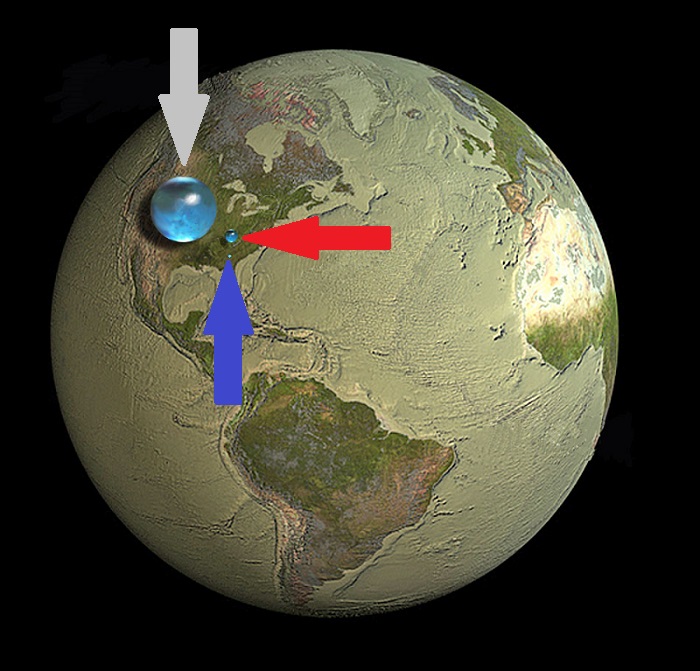
Sur l'image ci-dessous , vous pouvez observer le rapport qui existe entre la masse de la terre
et la masse d'eau qui occupe habituellement plus de 70% de sa surface !
Si l'on matérialise l'hydrosphère sous forme de "boules" , voilà ce que l'on obtient :
Flèche grise : Quantité globale de 1.4 milliard de km3 , diamètre de 1 380 km
(en comparaison à celui de la terre qui est de 12 700 km)
Flèche rouge : Représente les quantités d'eau "douce" (40 millions de km3 ) .
Cependant , une immense proportion de cette eau est totalement inaccessible et hors d'atteinte des êtres vivants ,
soit parce qu'elle est congelée dans les islandis , soit parce qu'elle est enfouie au plus profond de la terre !
Flèche bleue : Ce minuscule petit point de seulement 60 km de diamètre représente
la quantité d'eau "potable" partagée par l'humanité toute entière !
C'est donc dans cette "tête d'épingle" que plus de 7 milliards d'humains puisent quotidiennement pour boire ,
pour se laver , irriguer les cultures , abreuver les animaux ,
faire tourner les usines , alimenter les centrales électriques ... ou "se distraire" !
 De quoi éveiller la réflexion ...
De quoi éveiller la réflexion ...
________________________________________________________________________________
Philippe CLÉMENT - BÉAL .
Chamonix le 15 Novembre 2016
________________________________________________________________________________________________
Si vous souhaitez déposer un commentaire
Entrez simplement un Prénom , un Nom ou un Pseudo
Il est inutile (pour des raisons de confidentialité) d'inscrire votre adresse-mail ou toutes autres coordonnées
(N'oubliez pas de faire glisser la flèche de "l'anti-spam" avant de valider en cliquant sur le bouton "Ajouter")
Merci !
Commentaires (10)
- 1. | 16/11/2016
- 2. | 16/11/2016
J'ai de vagues souvenirs du nombre d'Avogadro et je me demandais si ce problème de probabilité pouvait aussi s'appliquer à d'autres sujets comme par exemple le brassage des gènes humains ?
Merci et à bientôt .
- | 16/11/2016
- 3. | 16/11/2016
Quand descendrez-vous de votre haute vallée pour venir à Bonneville nous parler particules ?
Merci monsieur Philippe et à bientôt j'espère
- 4. | 18/11/2016
J'ai bu votre excellent article,
J'ai failli m'y noyer par manque de connaissances. Pourtant, il est remarquablement didactique et clair.
Heureusement, mise en pratique des techniques de chasse sous marine et je vais m'y immerger de nouveau.
Descendant dans les profondeurs du circuit fermé, la narcose a dû me travailler !
Peux t'on concevoir que M. Benveniste pourrait raisonnablement remonter en surface ?
Encore merci pour votre magnifique exposé
Bien amicalement, Daniel
- | 19/11/2016
- 5. | 20/11/2016
Comme vous confirmiez à Laurence, ce type de raisonnement semble être applicable à d'autres sujets.
Il m'est revenu la lecture d'un article sur la ventilation (comptable) du dernier souffle de César
Mais ce qui m'amène à reprendre contact est beaucoup, beaucoup plus pernicieux.
Quel que soit le domaine, la Science bute partout sur des limites, tout en ouvrant des portes improbables.
Exemple ; l'aspect évolutif de la notion de temps, ou pire, l'intrication quantique.
Je pars donc du postulat qu' à priori tout est possible.
Au vu des connaissances actuelles, peut-on considérer qu'il existerait une impossibilité de dimensions inconnues, dimensions qui pourraient interférer avec notre Monde et rendre l'impensable possible ?
Amitiés, Daniel.
- | 23/11/2016
- 6. | 30/11/2016
Je n'ai découvert ton mail qu'aujourd'hui ... caché dans les spams ??
Billet passionnant .
L'eau a assurément des propriétés étonnantes . Il me semble même avoir lu quelque part que l'eau chaude gèle plus vite que l'eau froide . Qu'en est-il exactement ?
A quand une conférence ou un billet sur l'intrication quantique ? (l'idée m'est venue à la lecture des commentaires)
Avec toute mon amitié !
D de V .
- | 01/12/2016


Amitiés