Un "zeste" de Physico-Chimie ...
... Ou comment découvrir le moyen d'épater ses amis à l'heure de "l'apéro" !
__________________________________________________________________

"La science restera toujours la satisfaction du plus
haut désir de notre nature : la curiosité"
(Ernest Renan / L'avenir de la science / 1848)
_____________________________________________________________________________
Plus que partout ailleurs dans le monde , il est bien connu que dans notre pays , il n'est point besoin d'avoir un solide motif pour provoquer l'occasion de "trinquer" à notre bonne santé !
C'est donc sans raison particulière , si ce n'est celle de rendre hommage à notre riche terroir , que j'ai dans un premier temps , envisagé traiter de la "physico-chimie" du Vin !

Mais , après réflexion , je me suis dit que faire "l'autopsie" de ce fameux et précieux "nectar" pour la livrer également à des "Bourguignons" , n'était peut-être pas une très bonne idée !
"On ne fait pas tourner un Bourguignon en "Barrique" sans risquer de s'attirer ses "Foudres" " ... (Vieux dicton Haut-Savoyard ... ??)
Je me suis donc résolu à vous parler d'un liquide tout aussi festif , mais beaucoup plus basique et bien moins "classieux" : Le Pastis !
Bien ... Je vous invite donc à partager l'expérience des changements d'état de cet étonnant breuvage !
________________________________________________________________

"Troublante mixture" ...
Versez une dose dans un verre .
Vous remarquez qu'il est coloré mais transparent . Vous voyez bien à travers !
Maintenant , ajoutez-y très délicatement une toute petite quantité d'eau (l'idéal est de le faire au compte-gouttes) .
Vous constatez alors que très rapidement le mélange se trouble et devient laiteux bien avant que le ratio 50/50 ne soit atteint !
Que s'est-il passé ? Pourquoi l'ajout d'un peu d'eau provoque -t-il le changement d'état du Pastis ?
Pour le découvrir et le comprendre , intéressons-nous d'abord à sa composition !
A l'état "pur" , le Pastis (comme ses cousins "Ouzo" ou "Raki") contient une très forte quantité d'alcool (45 %) , le reste étant de l'eau (54,8 %) et une très infime proportion "d'Anéthol" (0,2 %) (huile essentielle extraite de l'Anis qui donne le goût caractéristique de cette boisson)
Vingt six autres composés (en quantités infinitésimales ) entrent également dans le "secret de fabrication" . Mais aucun d'eux ne participe à "l'effet Pastis" !
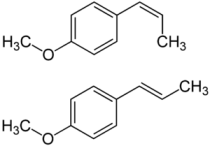
Anéthol cis-trans
Bien ... Résumons ... Huile + Eau + Alcool ... Ouille !! ... Pas simple de faire cohabiter ces trois éléments !
Huile / Eau / Alcool : "Ménage à 3" conflictuel !
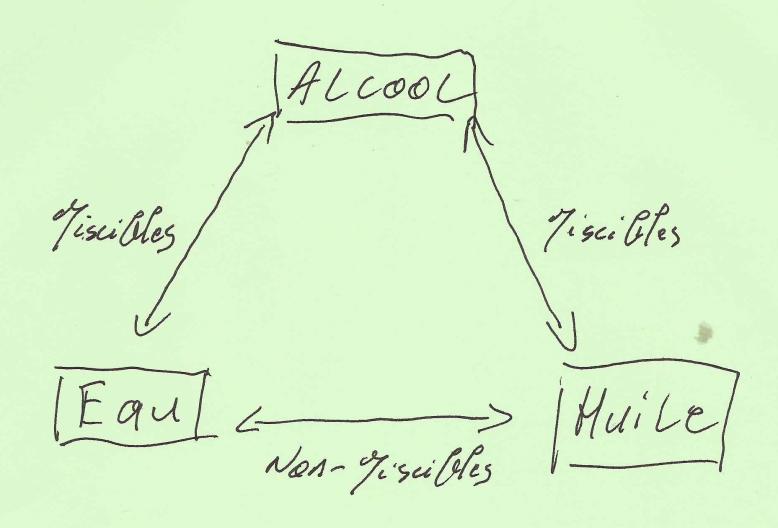
Comme vous le montre bien ce (magnifique) diagramme , vous voyez que l'huile et l'alcool se marient très facilement et qu'il en va de même pour l'eau et l'alcool . Ce qui , vous le savez , n'est pas le cas pour l'eau et l'huile !
Mais alors ? ... Comment se fait-il qu'un mélange comme le pastis "pur" qui contient pourtant à la fois de l'eau et de l'huile ne présente aucun symptôme du phénomène habituellement constaté de la non-miscibilité de ces deux éléments ? (couche huileuse en surface)
C'est tout simplement grâce à un parfait équilibre chimique dû au dosage préalable de ces trois composants ! La très faible proportion d'Anéthol se lie étroitement avec la très forte concentration d'alcool et est ainsi protégée de l'eau !
L'équilibre se rompt si on ajoute de l'eau au mélange initial .
De la phase de "Transition laiteuse" ...
Dès que la quantité d'eau du mélange initial augmente , l'Anéthol se trouve rapidement "contrarié" !
Il ressent très vite le besoin de se séparer de l'Alcool et de se "diviser" . Mais à l'inverse de l'huile d'olive (par exemple) qui se ségrégue immédiatement en formant une couche homogène à la surface de l'eau , l'huile essentielle d'Anis se répand en petites gouttelettes qui apparaissent spontanément et restent en suspension dans le mélange Eau / Alcool !
A ce stade de phase , nous sommes en présence d'une "émulsion" .
De l'origine de la transition laiteuse ...
Pour définir et expliquer la teinte laiteuse du pastis allongé , il faut s'intéresser à la taille des gouttelettes !
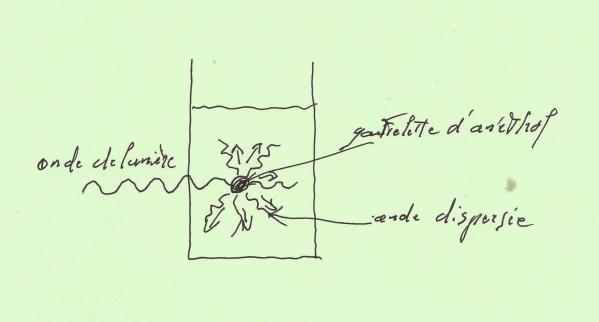
Le trouble que vous constatez dans votre verre est le résultat de la formation d'un nombre astronomique de gouttelettes d'huile mesurant à peine 1 micromètre de diamètre . (1 micromètre (µm) = 1 millième de millimètre)
Or , nous savons que des objets de quelques micromètres sont capables de diffuser la lumière . La raison principale étant que la lumière visible présente une longueur d'onde comprise entre 0,4 et 0,8 µm , donc assez proche de la taille des gouttelettes !
Ce qui fait que quand l'onde de lumière traverse la paroi du verre , elle vient se heurter aux gouttelettes d'huile qui la diffusent en tous sens dans le mélange , l'empêchant ainsi de ressortir de l'autre côté !
C'est donc grâce à ce phénomène "physique" que nous pouvons voir le "trouble" du Pastis .
Au regard de tout ce que nous avons constaté , nous pouvons donc affirmer que nous sommes bien en présence d'une combinaison "physico-chimique" !
A noter que c'est grâce à ce même principe de diffusion des ondes de lumière que nous pouvons voir les nuages ou la fumée !
De la "réinitialisation" de la transparence du Pastis ...
Je vous propose maintenant de poursuivre l'expérience en essayant de rendre sa transparence au mélange !
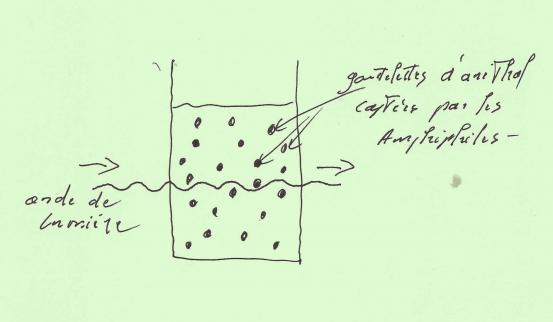
Pour cela , il nous faut trouver un composé capable de réorganiser les gouttelettes d'Anéthol pour les soustraire aux ondes de lumière !
Parce qu'il contient des molécules "Amphiphiles" , nous choisirons donc le "liquide vaisselle" !
Versez-en quelques gouttes dans le mélange et touillez !
A ce stade de l'expérience , la boisson devient impropre à la consommation !
Vous constatez alors que le mélange redevient transparent mais qu'il ne reprend pas tout à fait sa couleur d'origine . Ce qui est normal puisque la structure moléculaire du mélange initial a été modifiée de manière irréversible par l'ajout d'une plus grande quantité d'eau !
Mais , la lumière traverse à nouveau le verre de part en part !
Explications :
Les molécules "amphiphiles" contenues dans les savons sont des "tensioactifs" capables de créer l'interface entre deux milieux différents .
Ces acides gras , sous forme moléculaire ou ionique ont la particularité de posséder à la fois des propriétés "hydrophiles" et "hydrophobes" !
Dans le liquide vaiselle , les hydrophobes se présentent généralement sous forme de chaînes carbonées de formule : CH3(CH4)n .
Les hydrophiles sont presque toujours des carboxylates synthétisés en acides gras de formule : RCO2'Na+ .
En clair , c'est un peu comme une créature possédant une tête qui aime l'eau et une queue qui affectionne le gras !
Dans le Pastis allongé , l'action des amphiphiles va donc consister d'une part à se lier à l'eau sans problème , et d'autre part à "capturer" l'Anéthol en le réduisant en gouttelettes encore plus petites , ce qui aura pour effet de les soustraire au champ des ondes de lumière qui , n'étant plus diffusées , vont pouvoir traverser le verre de part en part !
Les lois de Physique et de Chimie s'exercent partout ... même dans un verre d'apéritif !
Fascinant ... Non ?
_________________________________________________________________________
Le "breuvage" dont je vous ai parlé étant soumis à stricte réglementation ,
il me faut ajouter qu'il doit être "consommé avec modération" !
__________________________________________________________________________________
Pour aller un peu plus loin ...
Dans ce petit exposé , nous avons vu que la phase de transition laiteuse , c'est à dire l'instant où les molécules d'Anéthol se séparent de l'Alcool et se répandent dans le mélange était une "émulsion" .
Nous avons également constaté que l'aspect visible de cette émulsion n'était pas irréversible puisque nous avons réussi à rendre sa transparence au mélange !
Mais , cette émulsion est-elle stable dans le temps et est-elle sensible à l'amplitude de température ambiante ?
Plusieurs échantillons statiques de Pastis soumis au spectromètre à diffusion de neutrons de l'ILL de Grenoble (*) , ont montré que les gouttelettes d'Anéthol ont tendance à beaucoup s'agiter et cherchent à se regrouper . Et plus la température augmente , plus ça "s'agite dans le bocal" !
On peut donc en déduire que l'émulsion du Pastis n'est pas stable dans le temps !
Vous pourrez facilement le vérifier en "oubliant" un verre de ce breuvage sur un coin de votre évier .
Vous constaterez dès le lendemain que les gouttelettes d'Anéthol se sont regroupées à la surface du mélange !
(*) : L'institut "Laue - Langevin" de Grenoble possède le spectromètre à diffusion de neutrons le plus puissant du monde .
La "bête" mesure 40 mètres de longueur et répond au doux patronyme de "D22" !
Elle est "domptée" de main de maître par la pétillante Dr "Isabelle" , qui est l'une de nos plus éminentes spécialistes en recherche sur les membranes biologiques !

Le cœur de la Bête
Pour aller encore un peu plus loin ...
Des études très sérieuses sur le diagramme de phase des mélanges ternaires sont menées par de nombreux laboratoires pour tenter de comprendre les circonstances dans lesquelles se produisent ces émulsions spontanées .
Elles ont déjà permis de nombreuses applications concrètes , notamment dans les domaines de la pharmacologie et de la cosmétique .
Pour les "accros" de thermodynamique :
Une émulsion est par définition un système thermodynamique instable puisque c'est la diffusion d'un liquide sous forme de gouttelettes dans un autre liquide , les deux étant non-miscibles !
Il faut donc chercher une zone de métastabilité d'un mélange ternaire entre les courbes binodales et les courbes spinodales pour espérer obtenir une microémulsion stable !
C'est à dire qu'il faut que les gouttelettes ne croissent pas trop vite et que les densités soient assez proches pour éviter que les corps gras ne soient ségrégés en surface !



________________________________________________________________________________
Pour aller encore et toujours un peu plus loin ...

Pour rafraîchir le Pastis et "sublimer" son goût , il est d'usage d'y plonger des glaçons , et lorsqu'on pose aux convives la question de savoir pourquoi des glaçons refroidissent un liquide quelconque , la réponse est pratiquement invariable : "parce qu'ils sont froids" !!
Oui ... mais Non ! Ce n'est pas tout à fait cela !
Pour comprendre ce qu'il se passe , prenons un exemple concret :
Sortez deux glaçons de votre congélateur , plongez-les dans votre verre (peu importe la nature du liquide) et demandez-vous quelle quantité de froid va être produite par vos glaçons !
Pour cela , il faut d'abord se rappeler que la chaleur , c'est de l'énergie et que "produire du froid équivaut à absorber de l'énergie" !
Les glaçons vont donc "prendre de l'énergie" à votre boisson pour la refroidir !
L'énergie se mesure en "Joules" , et pour calculer la quantité qui peut être absorbée sous forme de chaleur , il faut faire appel à sa "capacité calorifique" qui est de "2,1j par gramme et par degré" .
Si par exemple , vos deux glaçons pèsent 10g et sont initialement à moins 18°C , la quantité d'énergie qu'ils vont absorber en se réchauffant jusqu'à 0°C sera de :
2,1j x (10g) x (18°C) = 378 joules
Ce qui veut dire que pour passer de moins 18°C à 0°C , vos glaçons vont "pomper" 378 joules à votre Pastis !
Mais ce n'est pas tout , il se passe à ce moment là un petit "truc" en plus : Vos glaçons se mettent à fondre ...
Pour que la glace fonde , il faut qu'elle atteigne 0°C , tout le monde sait cela . Mais , "on" fait couramment l'erreur de penser que le phénomène de fusion est automatique dès que l'on arrive à cette température . Or , il n'en est rien ! Pour que vos glaçons fondent , il faut encore leur fournir une grosse quantité d'énergie !
Pour quantifier l'énergie nécessaire à la fusion d'un corps , on utilise une unité de valeur appelée "chaleur latente de fusion" , qui pour la glace équivaut à 330 joules par gramme .
Cela signifie que pour faire fondre vos deux glaçons pesant 10g , il faudra encore fournir :
330 (joules) x 10 (grammes) = 3 300 joules
A ce stade du processus , (glaçons fondus et transformés en eau liquide) il est important de comprendre que pour se transformer ils absorbent de l'énergie mais que leur température n'augmente pas !
Comme vous le constatez , l'énergie absorbée (et donc , le froid produit) lors de la fusion est presque 10 fois plus importante que celle nécessaire à son passage de moins 18°C à 0°C !
Donc , si les glaçons refroidissent un liquide ,
ce n'est pas uniquement parce qu'ils sont froids ,
c'est essentiellement parce qu'ils fondent !
Vous en tirerez donc la conclusion suivante :
Puisque c'est la "fonte" qui produit le plus de froid , vous n'utiliserez donc pas de "glaçons en plastique" remplis de gel qui eux ne fondent pas dans le verre !
... et n'oubliez pas les olives !
___________________________________________________________________________
Philippe Clément-Béal .
Chamonix le 27 Juillet 2017
____________________________________________________________________________
Si vous souhaitez déposer un commentaire
Entrez simplement un Prénom , un Nom ou un Pseudo
Il est inutile d'inscrire votre adresse mail
Merci
___________________________________________________________________________

Commentaires (8)
Comme l'aurait dit la Mère Denis : C'est ben vrai çà !!!
Cela va même crescendo : Stable puis métastable et enfin instable...
Et il n'y a pas que l'anéthol qui remonte en surface... Demandez donc à l'ami Jacob Delafon...
Merci pour cet exposé....qui m'amène à des interrogations de béotien.
Pourquoi et comment la gouttelette d'huile disperse la lumière ?
J'ai bien compris l'importance des dimensions mais physiquement, comment "qu' ça s'passe" ?
J'arrive maintenant à comprendre pourquoi un de mes amis, originaire de l' Est, buvait parfois le 51 sans le polluer avec de l'eau..... C'était pour garder une vision clair de l’échiquier qui jouxtait le verre !
Amitiés
Très intéressant billet . Je l'ai consommé "sans modération" .
Je ne savais pas que l'huile et l'alcool pouvaient se mélanger . Peux-tu m'expliquer ?
A+ mon gamin !